- Der Deutsche Apothekerverband und der GKV-Spitzenverband haben sich auf eine Umsetzung zur G‑BA-Regelung der Biosimilar-Substitution geeinigt.
- Die Einigung regelt zum 1. Juni 2024 die Umsetzung des G‑BA Beschlusses zum Austausch von biotechnologisch hergestellten biologischen Fertigarzneimitteln durch Apotheken bei parenteralen Zubereitungen zur unmittelbaren ärztlichen Anwendung.
- Hersteller von Biosimilars warnen vor unfairer Doppelrabattierung und damit einhergehenden Gefahren für den Standort.
Was ist passiert?
Der Gemeinsame Bundesausschuss (G‑BA) hatte mit seinem Beschluss zum automatischen Austausch von Biologika bei parenteralen Zubereitungen im Sommer 2023 erhebliche Diskussionen ausgelöst, denn die im Beschluss enthaltenen Regelungen sind sehr vage gehalten.
Wie die genaue Umsetzung in der Apotheken-Praxis funktionieren soll, war deshalb Gegenstand zahlreicher Spekulationen – und der Verhandlungen zwischen dem DAV und GKV-SV. Diese konnten sich nun einigen.
Wie soll der automatische Austausch in der Praxis funktionieren?
Hier kommt die sogenannten Hilfstaxe ins Spiel. Durch sie werden Abschläge geregelt und Preise gesenkt. Die vom G‑BA definierten Biologika beziehen sich auf sechs Wirkstoffe, deren Preise gedeckelt sind. Bei der Abgabe eines solchen Biologikums schaut der Apotheker in die Hilfstaxe und erfährt, was er der GKV in Rechnung stellen kann. Auf diese Weise sollen höchstmögliche Einsparungen erzielt werden.
Die Hilfstaxe gibt dem Apotheker nämlich nicht vor, welches Arzneimittel aus einer bestimmten Wirkstoffgruppe abgeben werden soll. Der Apotheker wird also versuchen, bei den Herstellern immer ein noch preisgünstigeres Präparat einzukaufen, was den Druck auf die Unternehmen weiter erhöht.
Wo ist das Problem?
Wie Generika werden nun auch Biosimilars einem extremen Kostendruck ausgesetzt. Denn: Laut Gesetz könnten nun die einzelnen Krankenkassen noch zusätzlich exklusive Rabattverträge ausschreiben, so wie sie es aktuell z. B. in Bayern tun. Würden diese noch hinzukommen, wäre das für die Biosimilars produzierenden Unternehmen eine unzumutbare Doppelbelastung. Denn dann wären zwei Mal Preisnachlässe zu gewähren, einmal über die Hilfstaxe und zusätzlich, über die Rabattverträge, an die Krankenkassen.
Eine gefährliche Entwicklung, die an die Kaskade der ungebremsten Kostensenkungs-Mechanismen bei den Generika erinnert.
Wie bewerten die Hersteller von Biosimilars diese Entwicklung?
„Das Experiment der automatischen Substitution hat mehr Risiken als die offenbar zusätzlich erwarteten Einsparungen rechtfertigen“, sagt Walter Röhrer, Vorsitzender der AG Pro Biosimilars. „Wirtschaftlichkeit um jeden Preis kostet uns am Ende die Vielfalt bei den Biosimilar-Unternehmen, die ohnehin begrenzt ist.“
„Massiver Kostendruck führt immer zu Verengungen in der Produktion und in den Lieferketten. Am Ende leidet durch das Ausquetschen der letzten Reserven an Wirtschaftlichkeit vor allem die Versorgungssicherheit.“
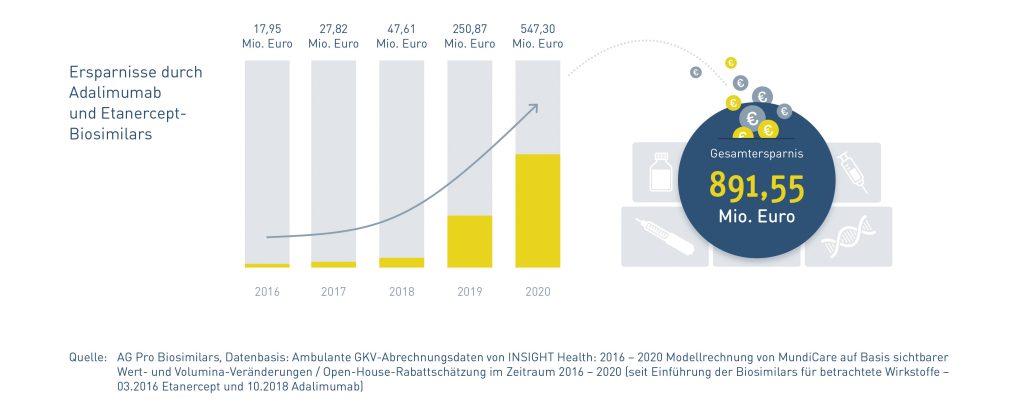
Biosimilars haben bereits oft eine hohe Marktdurchdringung von bis zu 90 Prozent und sorgen für Einsparungen in Milliardenhöhe. Zudem gibt es für sie bereits Rabattverträge. Jetzt den Preisdruck ungesteuert und ungenau weiter zu verstärken, gefährdet sehenden Auges den (noch) gut funktionierenden Biosimilars-Markt mit seinem hohen Grad an gesundem Wettbewerb.
Die falschen Entwicklungen bei Generika versucht die Politik gerade mühsam zurückzudrehen. Bei Biosimilars begibt sie sich auf genau den gleichen Irrweg.
Mehr erfahren: Alle Hintergrund-Informationen
Was genau ändert sich zum 01. Juni? Wie wird der G‑BA Beschluss in der Praxis umgesetzt? Welche Fragen bleiben offen? Antworten finden Sie hier: Link.
Pressefotos zum Download finden Sie hier: Link
30.05.2024