- Der stellvertretende Pro Generika-Vorsitzende Thomas Weigold (Sandoz) spricht auf dem Deutschen Krebskongress zur Versorgungslage bei Onkologika (Krebsmitteln).
- Das Beispiel des Brustkrebsmittels Tamoxifen hat gezeigt: Hohe Marktkonzentration und niedrige Erstattungspreise führen zu Lieferengpässen.
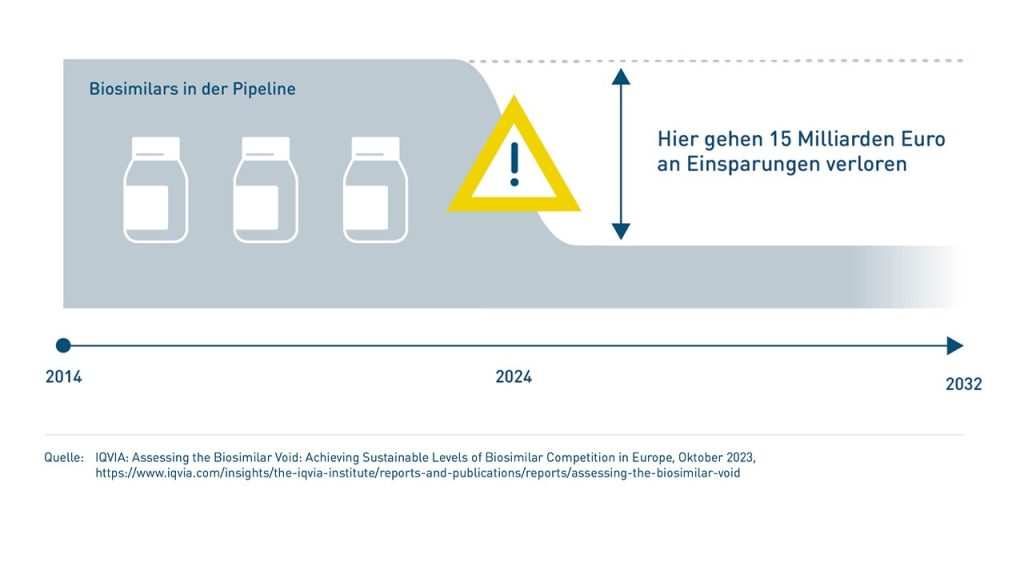
- Das ALBVVG bringt keine Verbesserungen für Onkologika. Und jetzt droht auch eine Verschlechterung der Versorgungslage mit onkologischen Biologika.
„Die Lieferengpässe bei Tamoxifen haben gezeigt, wie gefährlich die Kombination aus wenigen Anbietern und extrem geringen Erstattungspreisen für die Versorgung von Krebspatient:innen ist“, betont Thomas Weigold (Country President Sandoz Deutschland und stellvertretender Vorsitzender von Pro Generika) auf dem 36. Deutschen Krebskongress.
„Nur dank des Einsatzes der Generika-Unternehmen sind wir damals haarscharf an einer echten Unterversorgung vorbeigeschrammt. Doch die Politik scheint daraus nichts gelernt zu haben.
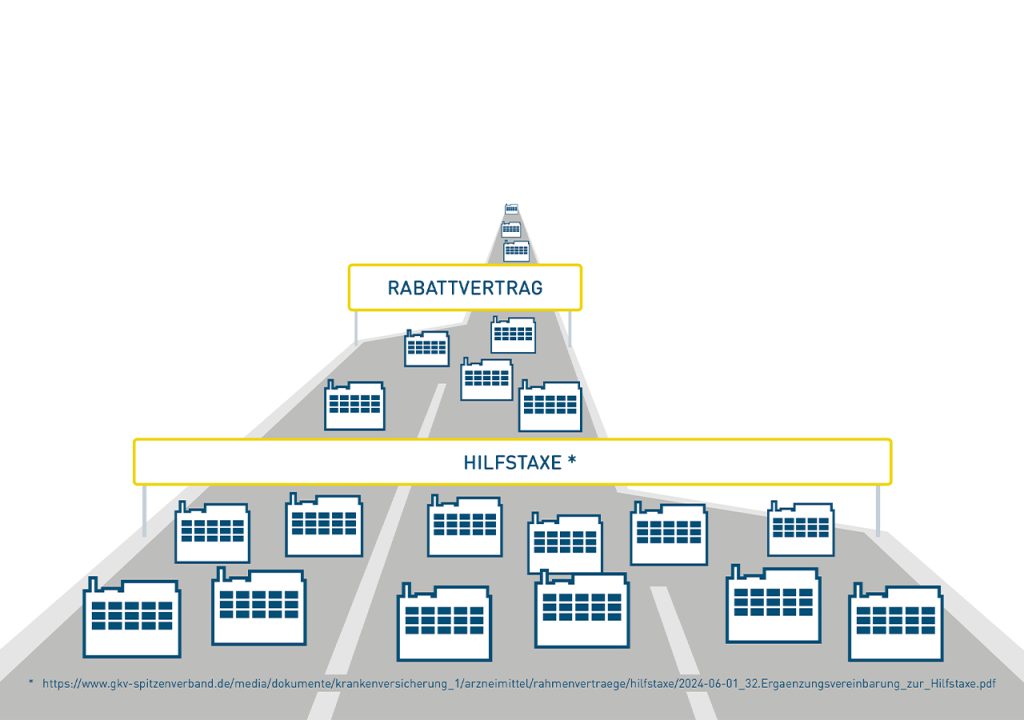
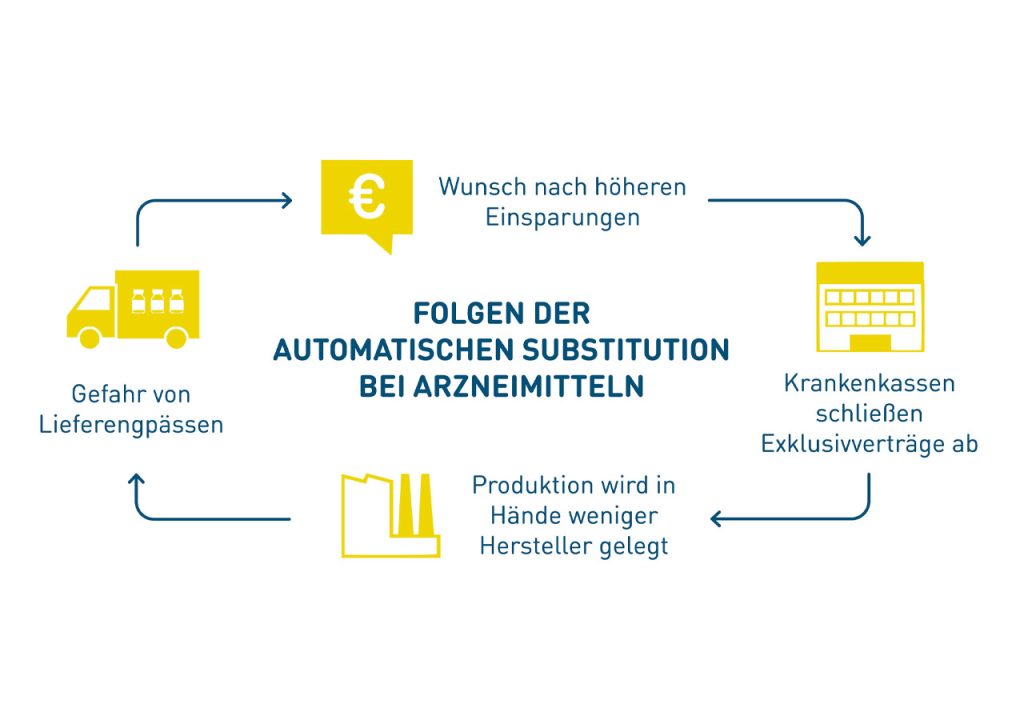
Nicht nur bringt das ALBVVG keine Verbesserungen für Onkologika. Mit dem Irrweg der automatischen Substitution von Biologika, mit der den Krankenkassen der Weg zu exklusiven Rabattverträgen geebnet werden soll, etabliert die Politik auch hier das Hauptsache-Billig-Prinzip. Damit begeht die Politik die gleichen Fehler wie bei Generika.
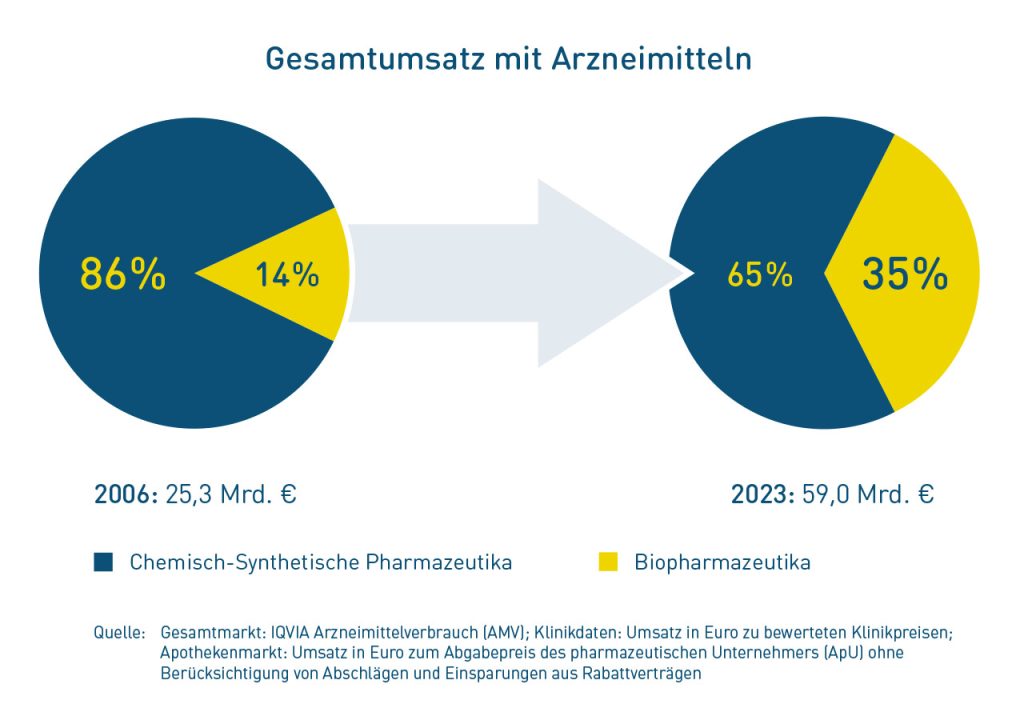
Dabei ist eins klar: Noch funktioniert der Markt mit Biosimilars. Wir haben Versorgungssicherheit, eine hohe Marktdurchdringung und eine gesunde Konkurrenzsituation sowie nahezu flächendeckende Rabattverträge, die zu massiven Einsparungen führen. Ein regulatorisches Eingreifen des Staates ist schlicht unnötig und schürt nur die Gefahr von Lieferengpässen.
Gerade bei onkologischen Biologika können wir uns aber keine Lieferengpässe leisten, denn die Patientinnen und Patienten sind in besonderem Maße auf ihre Arzneimittel angewiesen.
Noch können wir diese Fehlentwicklung aufhalten. Dafür braucht es den politischen Willen, aus gemachten Fehlern zu lernen und die Weichen für einen funktionierenden Biosimilars-Standort Deutschland zu stellen.“
Hintergrund:
Was es mit der automatischen Substitution auf sich hat, das lesen Sie hier: Link.
23.02.2024