Über die Hälfte unserer Biosimilars stammen aus Europa. Insbesondere Deutschland ist für die Branche ein wichtiger Standort.
Doch immer mehr Hersteller produzieren in Asien. Dabei kann auch Deutschland Standort! Allerdings nur, solange diese fünf Punkte hier sitzen:
1. Gute Unis und starke Mitbewerber
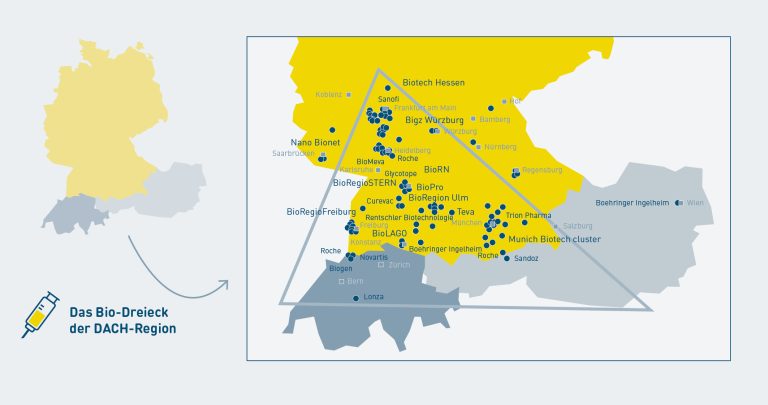
Konkurrenz belebt nicht nur das Geschäft: Sie schafft manchmal sogar erst die Basis dafür. Als Zentrum der Biotech-Branche gilt das „Bio-Dreieck“. Es zieht sich von Hessen über Süddeutschland nach Österreich und in die Schweiz. Hier gibt es einerseits international renommierte Universitäten und Hochschulen mit einem Fokus auf Chemie und Pharma, wie die TU München und die Uni Regensburg.
Andererseits sitzen hier etablierte Konzerne: Sanofi beispielsweise betreibt einen großen Chemiepark bei Frankfurt, Sandoz hat in Holzkirchen bei München ein neues Biosimilar-Entwicklungszentrum eröffnet und Roche betreibt im bayerischen Penzberg ein eigenes Zentrum für Biotechnologie. Als entsprechend eng gilt die Verzahnung zwischen Forschung und Wirtschaft, als gut die Infrastruktur. Und mit Deutschland liegt ein wichtiger Markt für die fertigen Produkte quasi direkt vor der Haustüre: In den letzten 12 Monaten wurden in Deutschland knapp 115 Millionen Tagesdosen von Biosimilars verordnet.
Wo Biosimilars weltweit produziert werden – und wie wichtig Deutschland und das „Bio-Dreieck“ für die Branche sind.
2. Fachkräfte, Fachkräfte, Fachkräfte
Auch auf die Nähe zu Universtäten und Hochschulen kommt es an: Hier werden hochqualifizierte Mitarbeiter:innen ausgebildet – in Zeiten des Fachkräftemangels ein großer Standortvorteil! Die Universitäten ziehen zudem ausländische Studierende an – und sorgen für ein Umfeld, in dem sich Start-ups entwickeln können.
Sichtbar ist das zum Beispiel in und um München. Als Vorbild gilt Micromet: Schon 1993 wurde das Biotechnologie-Unternehmen als Spin-off aus der Ludwig-Maximilians-Universität gegründet. Die Firma ist auf die Entwicklung neuer Krebsmedikamente spezialisiert. Zunächst kam sie, wie viele andere Start-ups aus diesem Bereich, im nahen Innovations- und Gründerzentrum Martinsried unter. Später wurde sie in Amgen eingegliedert. Ähnlich sieht es in der Region Regensburg aus. 2008 waren im dortigen Cluster für Biotechnologie, Pharma und Medizintechnik noch 40 Firmen gemeldet. 2022 waren es 66, mit zusammen mehreren Tausend Beschäftigten.
Auch der deutsche Maschinenbau ist ein wichtiger Wettbewerbsvorteil. „German Engineering“ ermöglicht im Bedarfsfall eine schnelle technische Unterstützung und Wartung, was für die Aufrechterhaltung einer effizienten Produktion unerlässlich ist.
3. Unternehmen, die investieren
Deutschland und Europa bieten Unternehmen Planungssicherheit – so können die Hersteller auch ihr Engagement ausbauen.
Als gutes Beispiel dient STADA. Bereits 2007 brachte das Unternehmen mit dem Wirkstoff Epoetin Zeta (Epo) eines der weltweit ersten Biosimilars gegen Anämie – auch Blutarmut genannt – in Zusammenhang mit Chemotherapien und chronischen Nierenerkrankungen auf den deutschen Markt.
Über das Joint Venture Norbitec mit Sitz in Schleswig-Holstein produziert STADA jährlich mehrere Millionen Dosen dieser biologischen Arzneimittel – und exportiert sie in die ganze Welt. Dank einer aufwendigen Zertifizierung im Jahr 2023 sichert der Hersteller sogar die Versorgung der Patienten in den USA mit dem einzigen Epo-Biosimilar weltweit. Dieses Engagement erfordert Investitionen – und zeigt, dass ein nachhaltiger Zugang zu qualitativ hochwertigen Arzneimitteln ‚made in Germany‘ gelingen kann.


Ein anderes Beispiel ist Sandoz: Das Unternehmen steckt viel Geld in europäische Projekte. Seit November 2023 arbeitet am Standort Holzkirchen eine neue klinisch-technische-Entwicklungseinheit an Biosimilars. Hier hat Sandoz 25 Millionen Euro investiert. Außerdem entsteht im slowenischen Lendava eine Produktionsanlage für Biologika, Ende 2026 soll die erste Stufe der neuen Fabrik in Betrieb gehen.
In Lendava betreibt die Sandoz-Tochter Lek bereits ein Generika-Werk – und ein großes Lager, was die Grundvoraussetzung ist, um Kunden weltweit beliefern zu können. Die Kombination der beiden Werke an einem Ort könnte daher, so die Hoffnung bei Sandoz, zusätzliche Synergien freisetzen. Dazu investiert der Konzern 400 bis 500 Millionen Euro. So viel Geld hat noch nie ein Unternehmen für ein einzelnes Vorhaben in Slowenien lockergemacht. Weitere 90 Millionen Euro fließen in den Ausbau des Forschungsstandorts Ljubljana.





4. Verlässliche Rahmenbedingungen
Biosimilar-Hersteller sind darauf angewiesen, dass sich ihre Investitionen refinanzieren. „Die Entscheidungen, die jetzt in Unternehmen getroffen werden, sehen wir erst in drei, in fünf, in zehn Jahren“, sagte etwa Jasmina Kirchhoff vom Institut der Deutschen Wirtschaft im Gespräch mit Pro Generika.
Doch nicht nur sie kritisiert, dass das Planen den Unternehmen in Deutschland derzeit schwer gemacht werde. Denn statt verlässlicher Rahmenbedingungen sehen sich viele Firmen einem steigenden Kostendruck ausgesetzt – auch durch staatliche Eingriffe in den Markt. Andere Länder dagegen wie Indien und China locken mit gezielter Unterstützung, statt zusätzliche Vorgaben zu machen. Die Folge lässt sich bereits beobachten: Produktionen wandern aus Deutschland und Europa ab.
5. Die Bereitschaft, für Versorgungssicherheit zu bezahlen
Und die Dynamik der Abwanderung droht sich sogar fortzusetzen. Denn die Politik plant, Biosimilars wie Generika zu behandeln. Schon jetzt sind einige Biopharmazeutika – nämlich die, die von Ärzt:innen parenteral, also per Spritze oder Infusion verabreicht werden – untereinander austauschbar. Diese sogenannte automatische Substitution ist auch für Fertigarzneimittel geplant.
Das Problem: Die automatische Substitution wird die Rahmenbedingungen für die Produktion von Biosimilars massiv verschlechtern – und eine ähnliche Entwicklung in Gang setzen wie bei den Generika. Denn sind Arzneimittel gegeneinander austauschbar, ermöglicht das exklusive Rabattverträge. Dabei erhält nur das Unternehmen den Zuschlag der Krankenkasse, das den günstigsten Preis bietet.
Für die Unternehmen bedeutet das: Sie müssen ihre Arzneimittel so billig wie möglich anbieten. Das aber gefährdet die Liefersicherheit, da die Hersteller einzelne Komponenten dort produzieren, wo es weltweit am günstigsten ist. So erhöht sich – analog zu Fiebersäften, Antibiotika und anderen Generika – die Gefahr von Engpässen. Und auch der Produktions- und Wissenstransfer gen Asien dürfte sich beschleunigen, fürchten Fachleute.



