Was sind Biosimilars?
2006 wurde das erste Biosimilar von der Europäischen Arzneimittelagentur (EMA) zugelassen. Seitdem werden Biosimilars immer häufiger und in immer mehr Indikationen zugelassen und eingesetzt.
Was Biosimilars genau sind, wie sie sich vom Originalpräparat unterscheiden und welche Personengruppen von ihrer Verwendung profitieren, erfahren Sie hier.
Was sind Biosimilars?
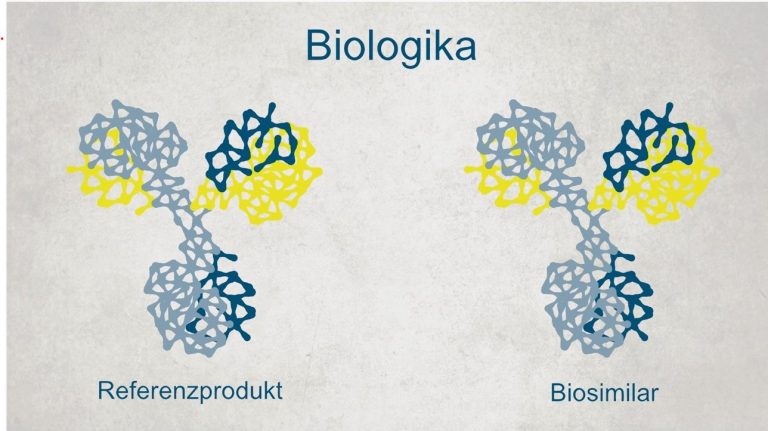
Biosimilars sind Nachfolgeprodukte von ehemals patentgeschützten Biopharmazeutika (auch: Erstanbieterpräparat). Sowohl das Erstanbieter- als auch das Nachfolgepräparat gehören somit zur Gruppe der Biologika. Das sind Arzneimittel, die mit Hilfe moderner Biotechnologie hergestellt werden. Im Unterschied zu klassischen, chemisch-synthetisierten Arzneimitteln werden sie aus lebenden Zellen erzeugt. Ein wesentliches Merkmal tragen sie bereits im Namen. Denn aufgrund ihres biologischen Ursprungs sind sie dem Erstanbieterpräparat immer nur sehr ähnlich (similar) – aber nicht gleich. Biosimilar-Moleküle sind größer als die chemischer Arzneimittel (etwa: Generika) und deutlich komplexer. Deshalb spricht man auch von „hochmolekularen Wirkstoffen“.
Was ist der Unterschied zu einem Generikum?
Anders als Generika, die durch eine chemische Synthese hergestellt werden und den absolut identischen Wirkstoff wie das ehemals patentgeschützte Präparat enthalten, werden Biosimilars mit Hilfe lebender Organismen produziert, meist in Zellkulturen. Die heute auf dem Markt verfügbaren biologischen Wirkstoffe stammen etwa aus Bakterien, Hefezellen oder Säugetierzellen. Mittels Verfahren der Biotechnologie werden sie gentechnisch verändert. Anders als Generika sind sie nie absolut identisch, aber stets vergleichbar.
In welchen Bereichen werden Biosimilars eingesetzt?
Vor allem in neuartigen Therapien von schweren, chronischen und lebensbedrohlichen Erkrankungen werden Biosimilars genutzt. In der EU zugelassene Biosimilars wie die Wirkstoffe Adalimumab, Filgrastim, Infliximab und Rituximab kommen in der Onkologie zur Behandlung von Krebs, bei Diabetes oder in der Rheumatologie zum Einsatz. Auch bei chronisch-entzündlichen Darmerkrankungen wie Morbus Crohn, in der Dermatologie bei Erkrankungen wie Psoriasis, bei Multipler Sklerose, in der Dialyse und bei Wachstumsstörungen werden Biosimilars verschrieben – meist als Flüssiglösung in einer Spritze oder Infusion per Tropf. Häufig erfolgt die Zulassung eines Biosimilars – analog zum Referenzprodukt – für die Therapie mehrerer Erkrankungen.
Wie häufig werden Biosimilars verschrieben?
Seit 2017 steigt der Bedarf an Biopharmazeutika stetig an. Analog steigt auch der Anteil der Biosimilars an der Versorgung – von 19,2 Millionen Tagestherapiedosen im Jahr 2017 auf 98, 4 Millionen im Jahr 2021. Dabei durchdringen Biosimilars den Markt immer schneller. Im Jahr 2021 wurde bei biopharmazeutischen Wirkstoffen mit Biosimilar-Konkurrenz im Schnitt zwei Drittel durch Biosimilars gedeckt.
Sind Biosimilars genauso wirksam und sicher wie das biologische Original?
Ja. Biosimilars weisen zum Erstanbieterprodukt keine klinisch relevanten Unterschiede auf, was Qualität, Wirksamkeit und Sicherheit angeht. Aufgrund ihres biologischen Ursprungs können sie aber niemals genau gleich sein.
Europäische Vorschriften regeln bereits seit 2003, welche Nachweise Biosimilar-Hersteller für die Zulassung erbringen müssen. Die Qualität und Sicherheit der Herstellung sind detailliert geregelt und beinhalten höchste Anforderungen hinsichtlich der Zulassungsvoraussetzungen, Produktionsprozesse und Qualitätskontrollen. Der gesamte Herstellungsprozess wird von deutschen und europäischen Behörden geprüft und überwacht.
Wie unterscheiden sich Biosimilars vom Original?
In Bezug auf Sicherheit, Wirksamkeit und Qualität gibt es keinen nennenswerten Unterschied zwischen Erstanbieterpräparat oder Biosimilars. Aufgrund ihres biologischen Ursprungs aber ist bei biologischen Arzneimitteln keine Charge mit einer anderen identisch. Das gilt für das Verhältnis von Biosimilar zum Original, von Biosimilar zu Biosimilar und von einzelnen Chargen innerhalb eines Präparats (Original wie Biosimilar). Diese Variabilität ist aber so gering, dass sie keine Auswirkung auf Wirksamkeit und Sicherheit hat.
Insofern ist die fortlaufende Behandlung mit „ähnlichen“ Versionen des gleichen Arzneimittels – also mit unterschiedlichen Chargen eines Biologikums – völlig unproblematisch und entspricht der gängigen Praxis seit Jahrzehnten, ohne dass es zur Zunahme der Immunogenität (Reaktion des Immunsystems) bzw. der Nebenwirkungen gekommen wäre.
Sind Biosimilars günstiger?
Ja! Nach Ablauf des Patentschutzes können mehrere Hersteller das biologische Arzneimittel herstellen, sofern sie zuvor eine Zulassung beantragt haben. Dafür müssen sie ein eigenes Herstellungsverfahren etablieren und Tests zur Wirksamkeit und Verträglichkeit im Labor und in klinischen Studien durchführen. Aber sie benötigen für die Zulassung ein deutlich kleineres Studienprogramm, als es der Erstanbieter vorweisen musste. Entsprechend können sie ihr Präparat günstiger anbieten.
Ein Beispiel: Für das weltweit umsatzstärkste Medikament Humira mit dem Wirkstoff Adalimumab, das bei Autoimmunerkrankungen wie Rheumatoider Arthritis und Morbus Crohn eingesetzt wird, standen nach dem Patentablauf 2018 gleich drei Biosimilar-Anbieter bereit. Im April 2022 war der Preis für die Tagestherapiedosis Adalimumab bereits um 44 Prozent gesunken.

Personen mit Krebs, Rheuma oder Morbus Crohn: Bei Erkrankungen wie diesen können Biosimilars verschrieben werden.
Kann ein Biosimilar gegen das Orginalpräparat ausgetauscht werden?
Die Zulassung von Biosimilars durch die EMA ist ein „Gütesiegel“. Mit ihm wird festgelegt, dass das Biosimilar bei denselben Erkrankungen zum Einsatz kommen kann, wie das entsprechende Präparat des Erstanbieters. Für die von der EMA zugelassenen Biosimilars heißt das, dass sie absolut gleichwertig und aus Sicht der Ärzteschaft eine vollwertige Alternative sind. Bei allen Biopharmazeutika – also auch Biosimilars – liegt die Entscheidung darüber, welches Präparat zum Einsatz kommen soll, immer beim behandelnden Arzt oder Ärztin.
Wie werden Biosimilars entwickelt?
Die Entwicklung eines Biosimilars ist aufwendig und langwierig. Zunächst erfolgen umfangreiche Analysen des Erstanbieterpräparats. Dann sind umfangreiche Studien nötig, die nachweisen, dass keine wesentlichen klinischen Unterschiede zum Original vorliegen. Grundsätzlich unterliegen Biosimilars den gleichen strengen Anforderungen an Qualität, Wirksamkeit und Arzneimittelsicherheit wie patentgeschützte Biopharmazeutika. Die Zulassung der in Europa eingesetzten Biosimilars erfolgt ausschließlich über die EMA.
Warum sinken die Preise bei einem Biosimilar nicht so stark wie bei einem Generikum?
Die Herstellung biopharmazeutischer Arzneimittel ist komplexer und langwieriger als bei Generika, darum können Hersteller die Preise nur bis zu einem gewissen Grad senken. Biosimilars sorgen jedoch an vielen Stellen im Gesundheitssystem für Einsparmöglichkeiten, nicht nur durch Preissenkungen: Kommen Biosimilars auf den Markt, wird der Wettbewerb neu entfacht, was nicht nur zu sinkenden Preisen bei Biosimilars und Erstanbieterpräparaten führt, sondern auch den Zugang zu Arzneimitteltherapien mit Biopharmazeutika für Patient:innen allgemein erweitert und in vielen Fällen sogar beschleunigt.
Zudem können Krankenkassen mithilfe des Wettbewerbsdrucks einfache Verträge mit Herstellern abschließen, die weitere Einsparungen für das System generieren. Bei einigen biopharmazeutischen Wirkstoffen wurden bereits Festbeträge festgesetzt – ein weiterer Weg für das System, Geld einzusparen, jenseits der Preissenkungen der Hersteller.
In unserem Erklärvideo "Was ist ein Biosimilar?" bringen wir die wichtigsten Informationen auf den Punkt.