Jüngst trat der G-BA-Beschluss zum „Austausch von biotechnologisch hergestellten biologischen Fertigarzneimitteln durch Apotheken bei parenteralen Zubereitungen zur unmittelbaren ärztlichen Anwendung“ in Kraft. Doch was folgt daraus jetzt für die Praxis? Wir haben darüber mit Expert:innen diskutiert.

Dafür stehen Wir!
gleiche Qualität
mehr Versorgung
geringere Kosten
Updates
Walter Röhrer (Biogen) als Vorsitzender der AG Pro Biosimilars bestätigt
Pressefotos zum Download
Automatische Substitution — Und Jetzt?
Pro Generika-Vorstand warnt vor Engpässen bei Krebs-Biologika
Von der Theorie in die Praxis: Was folgt aus dem G‑BA-Beschluss zur automatischen Substitution?
Diese 5 Punkte braucht es für einen starken Biosimilar-Standort
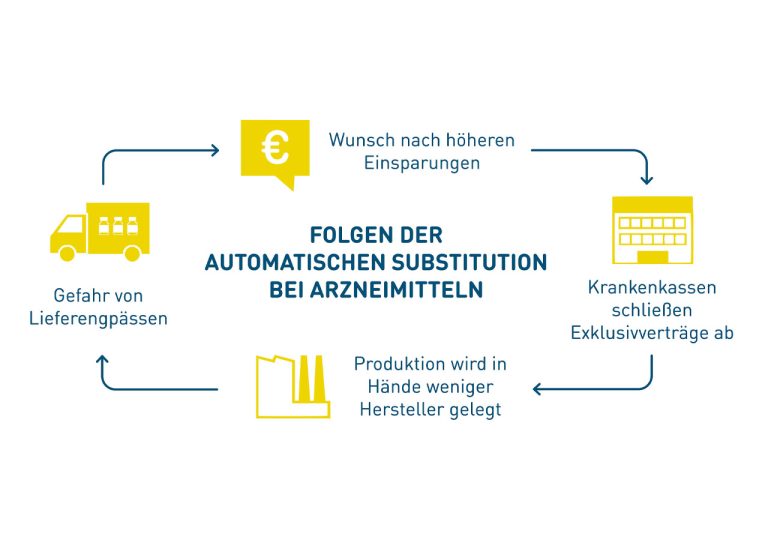
Die Gefahr von Lieferengpässen bei Biologika kann steigen, wenn der Generika-Teufelskreis wiederholt wird.
Gegen ihr Rheuma erhält Lynne ein Biopharmazeutikum. Wie das wirkt, was es verändert und warum es gut ist, dass es günstigere Nachahmerpräparate gibt, erklären wir hier.


Keinen Nutzen, hohe Risiken: Mehr Einsparungen sind bei Biosimilars nur auf Kosten der Versorgungssicherheit zu haben.